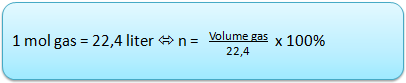Selasa, 24 Desember 2013
BAB 6. SISTEM LARUTAN
A. LARUTAN ELEKTROLIT DAN NONELEKTROLIT
1. Larutan Elektrolit
Larutan elektrolit adalah larutan zat terlarutnya dapat terionisasi dalam air sehingga dapat menghantarkan arus listrik.
1. Larutan Elektrolit
Larutan elektrolit adalah larutan zat terlarutnya dapat terionisasi dalam air sehingga dapat menghantarkan arus listrik.
BAB. 5 SISTEM KOLOID
A. KOLOID
koloid adalah campuran yang berada di antara larutan dan suspensi, terbentuk dari fase terdispersi dan pendispersi. Berikut adalah perbedaan larutan, koloid, dan suspensi :
B. JENIS - JENIS KOLOID
Keterangan :
T = Terdispersi
P = Pendispersi
C. SIFAT - SIFAT KOLOID
1. Efek Tyndall : peristiwa menghamburnya cahaya bila dipancarkan melalui sistem koloid
2. Gerak Brown : Gerakan dari partikel terdispersi dalam sistem koloid yang terjadi karena adanya tumbukan antarpartikel, gerakan ini sifatnya acak dan tidak berhenti.
3. Elektrofolesis : suatu proses pengamatan migrasi atau berpindahnya partikel - partikel dalam sistem koloid karena pengaruh medan listrik
4. Adsorpsi : proses penyerapan bagian permukaan benda atau ion yang dilakukan sistem koloid sehingga sistem koloid ini mempunyai muatan listrik
5. Koagulasi : suatu keadaan di mana partikel - partikel koloid membentuk suatu gumpalan yang lebih besar. Penggumpalan ini dikarenakan oleh beberapa faktor, contohnya karena penambahan zat kimia atau enzim tertentu.
koloid adalah campuran yang berada di antara larutan dan suspensi, terbentuk dari fase terdispersi dan pendispersi. Berikut adalah perbedaan larutan, koloid, dan suspensi :
B. JENIS - JENIS KOLOID
Keterangan :
T = Terdispersi
P = Pendispersi
C. SIFAT - SIFAT KOLOID
1. Efek Tyndall : peristiwa menghamburnya cahaya bila dipancarkan melalui sistem koloid
2. Gerak Brown : Gerakan dari partikel terdispersi dalam sistem koloid yang terjadi karena adanya tumbukan antarpartikel, gerakan ini sifatnya acak dan tidak berhenti.
3. Elektrofolesis : suatu proses pengamatan migrasi atau berpindahnya partikel - partikel dalam sistem koloid karena pengaruh medan listrik
4. Adsorpsi : proses penyerapan bagian permukaan benda atau ion yang dilakukan sistem koloid sehingga sistem koloid ini mempunyai muatan listrik
5. Koagulasi : suatu keadaan di mana partikel - partikel koloid membentuk suatu gumpalan yang lebih besar. Penggumpalan ini dikarenakan oleh beberapa faktor, contohnya karena penambahan zat kimia atau enzim tertentu.
BAB 4. KONSEP MOL DAN STOIKIOMETRI
Mol (n) adalah satuan internasional untuk menyatakan jumlah zat. Mol dapat dirumuskan dengan :
Dalam 1 mol zat terdapat 6,02 x 10 pangkat 23 partikel. Jumlah partikel zat di rumuskan dengan :
Keterangan :
n = mol
6,02 x 10 pangkat 23 = bilangan avogadro
Mr = Massa Molekul Relatif
Ar = Massa Atom Relatif
Keterangan :
P = tekanan ( atm ) R = tetapan 0,08205 atm.L/mol.K'
V = volume ( liter) T = suhu ( kelvin )
N = mol
B. STOIKIOMETRI
Stoikiometri mempelajari semua perhitungan kimia secara kuantitatif, tidak terbatas pada unsur saja tetapi juga perhitungan senyawa maupun campuran.
1. Hukum - Hukum Dasar Kimia
Hukum Lavoisier ( Kekekalan Massa ) : Massa zat sebelum reaksi sama dengan massa zat setelah reaksi.
Hukum Proust ( Ketetapan Perbandingan ) : Suatu senyawa perbandingan massa unsur- unsur penyusunnya selalu tetap.
Hukum Dalton ( Perbandingan Berganda ) : Jika unsur A dan unsur B membentuk lebih dari satu macam senyawa, maka untuk massa unsur A yang tetap, massa unsur B dalam senyawanya berbanding sebagai bilangan bulat sederhana.
2. Hukum - Hukum Ilmu Kimia Untuk Gas
Hukum Gay Lussac ( Perbandingan Volume ) : volume gas - gas yang bereaksi dengan volume gas - gas hasil reaksi akan berbanding sebagai bilangan ( koefisien ) bulat sederhana juka unsur pada suhu dan tekanan yang sama.
Rumus :
Hukum Avogadro : Gas - gas dalam volume sama akan mempunyai jumlah molekul yang sama jika diukur pada suhu dan tekanan yang sama. Dalam 1 mol zat mengandung 6,02 x 10 pangkat 23 partikel, yang disebut dengan bilangan avogadro
Rumus :
Hukum Boyle ( Ketetapan Hasil Kali Tekanan dan Volume ) : Hasil kali tekanan gas dan volume gas akan selalu tetap jika diukur pada suhu dan tekanan yang sama.
Rumus :
Hukum Boyle-Gay Lussac : Hasil kali tekanan gas dan volume gas akan selalu tetap jika dibagi suhu mutlak.
Rumus :
C. RUMUS EMPERIS DAN RUMUS MOLEKUL
1. Rumus Emperis
Rumus emperis adalah rumus yang paling sederhana dalam kompilasi suatu senyawa
2. Rumus Molekul
Rumus molekul adalah kelipatan dari rumus emperis
D. MASSA ATOM RELATIF DAN MASSA MOLEKUL RELATIF
1. Massa Atom Relatif ( Ar )
Massa atom relatif ( Ar ) atau juga disebut bobot atom ( BA ) suatu unsur adalah massa satu atom unsur tersebut dibagi dengan 1/12 massa atom isotop karbon 12.
Menentukan Massa Atom Relatif Dari Isotop - Isotop di Alam
Di alam suatu unsur bisa didapatkan dalam 2 jenis atau bahkan lebih isotop, oleh karena itu kita dapat menentukan massa atom relatifnya dengan rumus berikut. Untuk n jenis isotop :
K = Kelimpahan
2. Massa Molekul Relatif ( Mr )
Massa molekul relatif ( Mr ) atau juga disebut bobot melekul ( BM ) suatu senyawa adalah massa satu molekul senyawa tersebut dibagi dengan 1/12 massa satu atom isotop karbon 12.
E. AIR KRISTAL
Air kristal ( hidrat ) adalah air yang terikat pada suatu kristal senyawa tertentu dengan perbandingan molekul yang tertentu pula. Air ini dapat dibebaskan melalui pemanasan. Contoh air kristal : CuSO4.5H2O, FeSO4.7H2O, 2H2O dsb.
Dalam 1 mol zat terdapat 6,02 x 10 pangkat 23 partikel. Jumlah partikel zat di rumuskan dengan :
Keterangan :
n = mol
6,02 x 10 pangkat 23 = bilangan avogadro
Mr = Massa Molekul Relatif
Ar = Massa Atom Relatif
- Pada kondisi standar dimana suhu 0 derajat celcius dan tekanan 1 atm ( standard temperature and pressure = STP ) :
- Pada kondisi bukan standar maka kita gunakan rumus ideal :
Keterangan :
P = tekanan ( atm ) R = tetapan 0,08205 atm.L/mol.K'
V = volume ( liter) T = suhu ( kelvin )
N = mol
- Pada kondisi suhu dan tekanan sama ( P, T ) :
B. STOIKIOMETRI
Stoikiometri mempelajari semua perhitungan kimia secara kuantitatif, tidak terbatas pada unsur saja tetapi juga perhitungan senyawa maupun campuran.
1. Hukum - Hukum Dasar Kimia
Hukum Lavoisier ( Kekekalan Massa ) : Massa zat sebelum reaksi sama dengan massa zat setelah reaksi.
Hukum Proust ( Ketetapan Perbandingan ) : Suatu senyawa perbandingan massa unsur- unsur penyusunnya selalu tetap.
Hukum Dalton ( Perbandingan Berganda ) : Jika unsur A dan unsur B membentuk lebih dari satu macam senyawa, maka untuk massa unsur A yang tetap, massa unsur B dalam senyawanya berbanding sebagai bilangan bulat sederhana.
2. Hukum - Hukum Ilmu Kimia Untuk Gas
Hukum Gay Lussac ( Perbandingan Volume ) : volume gas - gas yang bereaksi dengan volume gas - gas hasil reaksi akan berbanding sebagai bilangan ( koefisien ) bulat sederhana juka unsur pada suhu dan tekanan yang sama.
Rumus :
Hukum Avogadro : Gas - gas dalam volume sama akan mempunyai jumlah molekul yang sama jika diukur pada suhu dan tekanan yang sama. Dalam 1 mol zat mengandung 6,02 x 10 pangkat 23 partikel, yang disebut dengan bilangan avogadro
Rumus :
Hukum Boyle ( Ketetapan Hasil Kali Tekanan dan Volume ) : Hasil kali tekanan gas dan volume gas akan selalu tetap jika diukur pada suhu dan tekanan yang sama.
Rumus :
Hukum Boyle-Gay Lussac : Hasil kali tekanan gas dan volume gas akan selalu tetap jika dibagi suhu mutlak.
Rumus :
C. RUMUS EMPERIS DAN RUMUS MOLEKUL
1. Rumus Emperis
Rumus emperis adalah rumus yang paling sederhana dalam kompilasi suatu senyawa
2. Rumus Molekul
Rumus molekul adalah kelipatan dari rumus emperis
D. MASSA ATOM RELATIF DAN MASSA MOLEKUL RELATIF
1. Massa Atom Relatif ( Ar )
Massa atom relatif ( Ar ) atau juga disebut bobot atom ( BA ) suatu unsur adalah massa satu atom unsur tersebut dibagi dengan 1/12 massa atom isotop karbon 12.
Menentukan Massa Atom Relatif Dari Isotop - Isotop di Alam
Di alam suatu unsur bisa didapatkan dalam 2 jenis atau bahkan lebih isotop, oleh karena itu kita dapat menentukan massa atom relatifnya dengan rumus berikut. Untuk n jenis isotop :
K = Kelimpahan
2. Massa Molekul Relatif ( Mr )
Massa molekul relatif ( Mr ) atau juga disebut bobot melekul ( BM ) suatu senyawa adalah massa satu molekul senyawa tersebut dibagi dengan 1/12 massa satu atom isotop karbon 12.
E. AIR KRISTAL
Air kristal ( hidrat ) adalah air yang terikat pada suatu kristal senyawa tertentu dengan perbandingan molekul yang tertentu pula. Air ini dapat dibebaskan melalui pemanasan. Contoh air kristal : CuSO4.5H2O, FeSO4.7H2O, 2H2O dsb.
BAB 3. IKATAN KIMIA
A. JENIS-JENIS IKATAN KIMIA
1. Ikatan Antar Atom
a. Ikatan Ion atau Ikatan Elektrovalen
Ikatan atom unsur logam unsur logam (elekropositif) dengan atom unsur nonlogam (elektronegatif). Unsur negaif memberikan elektronnya pada unsur nonlogam.
b. Ikatan Kovalen
Ikatan atom unsur nonlogam dengan atom unsur nonlogam. Pemakaian bersama elektron dari kedua unsur tersebut.
c. Ikatan Kovalen Polar
Ikatan kovelen dimana pasangan elektron ikatan (PEI) tertarik lebih kuat salah satu atom. Pasangan elektron akan tertarik ke atom yang memiliki keleektronegatifan lebih besar.
d. Ikatan Kovalen Non Polar
Ikatatan kovalen dimana pasangan elektron ikatan ( PEI ) tertarik sama kuat ke seluruh atom.
e. Ikatan Kovalen Rangkap
Ikatan atom unsur nonlogam dengan atom unsur nonlogam. Terdapat pemakaian bersama lebih dari satu pasangan elektron.
f. Ikatan Kovalen Koordinasi
Ikatan atom unsur nonlogam dengan atom unsur nonlogam. Pemakaian bersama elektron dari salah satu unsur.
Sifat-Sifat Ikatan Ion dan Kovalen
2. Ikatan Antar Molekul
a. Ikatan Van Der Waals
Ikatan yang terjadi akibat adanya gabungan gaya london dan gaya tarik antar dipol.
- Gaya tarik antar molekulnya relatif lemah. Contoh : H2, N2, CH2 dan gas-gas mulia
- Gaya tarik antar molekulnya lebih kuat dari gaya tarik antara molekul dipol sesaat-dipol terimbas
b. Ikatan Hidrogen
Terjadi antara atom H dari suatu molekul dengan atom F atau O atau atom N pada molekul lain. Ada perbedaan suhu tinggi dan sangat polar di antara molekul-molekulnya. Contoh : HF, H2O, dan NH3
c. Ikatan Logam
Ikatan ion logam dengan ion logam dengan bantuan kumpulan elektron sebagai pengikat atom-atom positif logam. Ikatannya membentuk kristal logam. Contoh : Campuran tembaga dengan seng membentuk kuningan.
B. BENTUK GEOMETRI MOLEKUL
Berbagai kemungkinan bentuk molekul :

Keterangan :
A = Atom Pusat
X = jumlah pasangan elektron ikatan
E = Jumlah pasangan elektron bebas
C. HIBRIDISASI
Proses pembentukan orbital karena adanya gabungan ( peleburan ) dua atau lebih orbital atom dalam suatu satuan atom. Konsep hibridisasi ini terjadi misalnya pada senyawa CH4
Berbagai kemungkinan lain hibridisasi dan bentuk geometri orbital hibridanya sebagai berikut :
1. Ikatan Antar Atom
a. Ikatan Ion atau Ikatan Elektrovalen
Ikatan atom unsur logam unsur logam (elekropositif) dengan atom unsur nonlogam (elektronegatif). Unsur negaif memberikan elektronnya pada unsur nonlogam.
b. Ikatan Kovalen
Ikatan atom unsur nonlogam dengan atom unsur nonlogam. Pemakaian bersama elektron dari kedua unsur tersebut.
c. Ikatan Kovalen Polar
Ikatan kovelen dimana pasangan elektron ikatan (PEI) tertarik lebih kuat salah satu atom. Pasangan elektron akan tertarik ke atom yang memiliki keleektronegatifan lebih besar.
d. Ikatan Kovalen Non Polar
Ikatatan kovalen dimana pasangan elektron ikatan ( PEI ) tertarik sama kuat ke seluruh atom.
e. Ikatan Kovalen Rangkap
Ikatan atom unsur nonlogam dengan atom unsur nonlogam. Terdapat pemakaian bersama lebih dari satu pasangan elektron.
f. Ikatan Kovalen Koordinasi
Ikatan atom unsur nonlogam dengan atom unsur nonlogam. Pemakaian bersama elektron dari salah satu unsur.
Sifat-Sifat Ikatan Ion dan Kovalen
2. Ikatan Antar Molekul
a. Ikatan Van Der Waals
Ikatan yang terjadi akibat adanya gabungan gaya london dan gaya tarik antar dipol.
- Gaya Dispersi ( Gaya London )
- Gaya tarik antar molekulnya relatif lemah. Contoh : H2, N2, CH2 dan gas-gas mulia
- Gaya Tarik Dipol
- Gaya tarik antar molekulnya lebih kuat dari gaya tarik antara molekul dipol sesaat-dipol terimbas
b. Ikatan Hidrogen
Terjadi antara atom H dari suatu molekul dengan atom F atau O atau atom N pada molekul lain. Ada perbedaan suhu tinggi dan sangat polar di antara molekul-molekulnya. Contoh : HF, H2O, dan NH3
c. Ikatan Logam
Ikatan ion logam dengan ion logam dengan bantuan kumpulan elektron sebagai pengikat atom-atom positif logam. Ikatannya membentuk kristal logam. Contoh : Campuran tembaga dengan seng membentuk kuningan.
B. BENTUK GEOMETRI MOLEKUL
Berbagai kemungkinan bentuk molekul :

Keterangan :
A = Atom Pusat
X = jumlah pasangan elektron ikatan
E = Jumlah pasangan elektron bebas
C. HIBRIDISASI
Proses pembentukan orbital karena adanya gabungan ( peleburan ) dua atau lebih orbital atom dalam suatu satuan atom. Konsep hibridisasi ini terjadi misalnya pada senyawa CH4
Berbagai kemungkinan lain hibridisasi dan bentuk geometri orbital hibridanya sebagai berikut :
BAB 2. ATOM & SISTEM PERIODIK UNSUR
A. STRUKTUR ATOM
1. Perkembangan Model Atom
- Model Atom Dalton
- Atom mempunyai sifat yang sama atau identik untuk unsur tertentu
- Atom akan berikatan untuk membentuk suatu molekul
- Model Atom Thomson
- Terkenal dengan model atom roti kismis, terkena bagian pejal bermuatan positif dan elektron ( bermuatan negatif ) mengelilingi seperti kismis dalam roti.
- Model Atom Rutherford
- Atom bersifat netral karena jumlah muatan positif sama dengan jumlah muatan negatif.
- Model Atom Niels Bohr
- Elektron beredar pada lintasan dengan tingkat energi tertentu.
-Perpindahan elektron disertai penyerapan atau pelepasan energi
- Atom seperti sistem tata surya yaitu inti atom sebagai matahari dan elektron sebagai planet-planet di sekitarnya dalam orbit tertentu.
- Model Atom Broglie ( Mekanika Gelombang )
- Elektron tidak mempunyai lintasan tertentu. Elektron menempati jarak-jarak tertentu dari inti atom.
-Kedudukan elektron tidak dapat dipastikan, hanya merupakan kebolehjadian.
2. Partikel Dasar Penyusun Atom
3. Lambang Atom
Atom Netral = Atom yang tidak bermuatan listrik
- Proton = Elektron = Nomor Atom
- Netron = Massa Atom - Nomor Atom
Atom yang kelebihan elektron karena masuknya elektron unsur lain kedalam atom tersebut.
- Proton = Nomor Atom
- Elektron = Nomor Atom + Muatan
- Netron = Massa Atom - Nomor Atom
4. Nuklida
adalah inti atom suatu unsur yang mengandung proton dan netron
- Isotop adalah nuklida yang mempunyai nomor atom sama tetapi massa atomnya berbeda atau jumlah proton sama tetapi jumlah netron berbeda.
- Isobar adalah nuklida yang mempunyai nomor atom berbeda tetapi massa atomnya sama
- Isoton adalah nuklida yang mempunyai jumlah netron yang sama tetapi nomor atom dan massa atomnya berbeda.
B. KONFIGURASI ELEKTRON
adalah suatu susunan mengenai penyebaran elektron pada kulit suatu atom.
1. Bilangan Kuantum
Bilangan yang menentukan letak keberadaan elektron pada kulit suatu atom
a. Bilangan Kuantum Utama ( n )
Menyatakan nomor kulit tempat elektron berada, jenisnya : K ( n = 1 ), L ( n = 2 ), M ( n = 3 ).
b. Bilangan Kuantum Azimuth (e)
Menyatakan subkulit tempat elektron berada, jenisnya :
c. Bilangan Kuantum Magnetik ( m )
Menyatakan orbital tempat elektron berada, jenisnya :
d. Bilangan Kuantum Spin ( s )
Menyatakan arah elektron dalam orbital.
+1/2 dan -1/2 untuk orbital dalam harag m, untuk menentukan letak elektron maka perlu mengikuti aturan-aturan tertentu yang sudah ditetapkan.
Aturan Aufbau
Elektron - elektron yang megisi orbital dari tingkat energi terendah kemudian tingkat energi yang lebih tinggi
Diagram dibawah ini adalah cara untuk mempermudah menentukan tingkat energi orbital dari yang terendah ke yang lebih tinggi, berikut diagramnya
Contoh :
Atom Li mempunyai 3 elektron maka konfigurasinya adalah : 1s2, 2s1
Atom Fe mempunyai 26 elektron maka konfigurasinya adalah : 1s2, 2s2, 2p6, 3p6, 4s2, 3d6
Autarn Hund :
Elektron- elektron tidak membentuk pasangan elektron sebelum masing-masing orbital terisi sebuah elektron
Larangan Pauli :
Tidak diperbolehkan di dalam atom terdapat elektron yang mempunyai keempat bilangan kuantum yang sama
2. Beberapa Hal Penting Yang Perlu Diperhatikan Dalam Konfigurasi Elektron
a. Cara Menuliskan Urutan Subkulit
- Subkulit dituliskan berdasarkan tingkat energinya
(Ga) = 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p1
Tingkat energi subkulit 4s lebih rendah dari subkulit 3d, maka akan terisi elektron terlebih dahulu dan di tulis lebih dahulu.
- Subkulit ditulis berdasarkanurutan kulit utamanya
(Ga) : 1s2, 2s2, 2p6, 3s2, 3p6, 3d10, 4s2, 4p1
Walaupun tingkat energi subkulit 4s lebh rendah dari subkulit 3d, tetapi penulisannya berdasarkan urutan kulit utamanya adalah seperti di atas, jadi 3d di tulis lebih dulu
- Subkulit di tulis dengan menggunakan konfigurasi gas mulia
( Ga ) : [Ar] 4s2, 3d10, 4p1 atau [Ar] 3d10, 4s2, 4p1
Gas mulia disini yang dipakai adalah Argon (Ar) yang mempunyai nomor atom =18
b. Aturan Penuh-Setengah Hund
Dalam percobaan ternyta di temukan beberapa penyimpangan aturan Aufbau, sebagai contoh adalah untuk konfigurasi elektron kromium ( Cr ) dan tembaga ( Cu ) :
- Berdasarkan aturan Aufbau
- Berdasarkan percobaan menjadi :
- Cu : 1s2, 2s2, 2p6, 3s2, 3p6, 4s1, 3d10 atau [Ar] 4s1, 3d10 ( penuh untuk sub kulit d )
untuk subkulit d, terisi elektron setengah penuh atau penuh ternyata lebih stabil dibandingkan jika menggunakan aturan Aufbau.
C. SISTEM PERIODIK UNSUR
Adalah susunan unsur-unsur berdasarkan kenaikan nomor atom dan kemiripan sifat-sifat yang dimiliki oleh masing-masing unsur
Henry G. Moseley
Menemukan sistem periodik unsur modern dan menyatakan sifat unsur merupakan sifat periodik dari nomor atomnya dimana nomor atom merupakan jumlah proton dan eletron sebuah unsur netral. SPU Modern tersusun atas :
1. Golongan
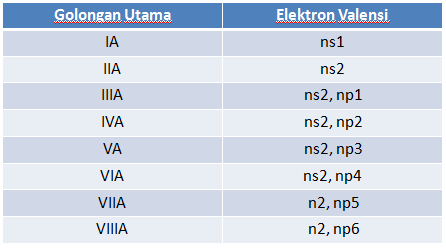
Baris vertikal menyatakan unsur-unsur yang segolongan. Segolongan berarti mempunyai elektron valensi ( elektron pada kulit terluar ) sama.
Golongan = Elektron Valensi
ada dua golongan unsur-unsur dalam SPU : Golongan Utama adalah Golongan A dan Golongan Transisi adalah Golongan B
Nama Golongan Pada Golongan Utama :
2. Periode
Baris horizontal menyatakan unsur-unsur yang dilaluinya sebagai unsur-unsur yang seperiode, seperiode berarti mempunyai jumlah kulit atom sama. Periode = Jumlah Kulit
D. SIFAT PERIODIK UNSUR
1. Jari-jari atom adalah jarak antara inti atom dengan kulit atom paling luar yang ditempati elektron dan diukur ketika atom tersebut baerikatan.
2. Potensial ionisasi ( energi ionisasi ) adalah energi yang di butuhkan untuk membebaskan satu elektron suatu atom pada keadaan gas.
3. Afinitas elektron adalah energi yang dibebaskan atom netral dalam pengikatan elektron untuk membentuk ion negatif
4. Kelogaman dan keasaman
5. Elektonegatifitas adalah kedendrungan suatu atom menarik pasangan elektronnya dalam molekul. Maksimum di golongan halogen, gas mulia lebih kecil keelektronegatifannya di banding Halogen.
6. Kereaktifannya, yaitu kemudahan melakukan reaksi denga unsur lain.
BAB 1. MATERI & PERUBAHANNYA
A. MATERI
Materi adalah sesuatu yang mempunyai massa, volume, menempati suatu ruang. Contoh : zat padat, cair, dan gas.
1. Klasifikasi Materi
a. Zat Tunggal : zat yang terdiri dari 1 jenis materi.
1) Unsur : zat tunggal yang palin sederhana dan tidak dapat di uraikan secara kimia biasa.
- contoh unsur yang tersusun atas atom unsur adalah : Fe ( Ferum ), Na ( Natrium ), Ca ( Kalsium ), Mn ( Mangan ).
- contoh unsur kimia yang tersusun atas molekul unsur adalah H2 ( Hidrogen ), N2 ( Nitrogen ), O2 ( Oksigen ), dan Cl2 ( Klorin ).
2) Senyawa : zat tunggal yang dapat terurai secara kimia menjadi zat-zat yang lebih sederhana. Senyawa tersusun oleh molekul senyawa. Contoh : H2O ( air ), NH3 ( amoniak ), CO2 ( Karbon dioksida ).
b. Campuran : bentuk materi yang terdiri atas lebih dari satu jenis materi. Campuran dapat dibagi dalam 3 jenis, yaitu :
1) Larutan : Campuran yang bersifat homogen ( serba sama ) dan terdiri dari 2 komponen, yaitu pelarut ( solven ) dan zat terlarut ( solute ). ukuran partikel < 1 nanometer ( 1 nm = 10 pangkat -9 m ). Contoh larutan adalah air gula, dan air garam.
2) Koloid : Campuran yang bersifat heterogen yang merupakan dispersi dengan zat terdispersi. Koloid memiliki ukuran 1 nm -100 nm. Contoh : Susu, tinta, cat, dan asap.
3) Suspensi : Campuran yang bersifat heterogen dan memiliki ukuran lebih besar dari 100 nm. contoh : lumpur, pasir dari sungai.
2. Partikel Penyusun Materi
a. Partikel Unsur
- Atom : bagian zat yang tidak dapat di bagi, contoh : Fe, Na,Ca, dll
- Molekul : bagian zat yang dapat dipisahkan menjadi atom, Contoh : O2, H2, N2, F2, Cl2, dll.
b. Partikel Senyawa
Senyawa terdiri atas molekul atau kumpulan atom-atom yang berbeda, contoh : H2SO4, HCL, H2O.
B. TANDA ATOM UNSUR
1. Unsur Logam
- Berbentuk padat dalam temperatur ruang, kecuali raksa ( cair )
- Penghantar listrik dan panas yang baik, contoh : Aluminium ( Al ), besi ( Fe ).
- Terdapat dalam 3 fasa, padat, cair, dan gas.
- Penghantar panas dan listrik yang buruk, contoh : Nitrogen ( N ), Brom ( Br ).
mempunyai beberapa sifat logan dan beberapa sifat non logam. Contoh : Arsen ( As ), Boron ( B ).
C. PERSENYAWAAN
1. Senyawa Biner Unsur Non Logam
Perhatikan urutan unsur-unsur berikut ini.
B - Si - C - Sb - As - P -N - H - Te - Se - S - I - Br - Cl - O - F
a. Unsur yang tertulis lebih dulu jika bersenyawa dengan unsur yang tertulis berikutnya maka dalam senyawanya juga ditulis lebih dulu.
b. Unsur yang di belakang ditambah akhiran - ida
c. Jika pasangan unsur yang bersenyawa dapat membentuk lebih dari satu macam senyawa, maka membedakannya dengan menyebut indeks dalam bahasa Yunani sebagai awalan ( cacatan : awalan mono- untuk unsur di depan tidak perlu ditulis).
1 = mono, 2 = di, 3 =tri, 4 = tetra, 5 = penta.
Contoh :
PCl3 = Fosfor triklorida
PCL5 = Fosfor pentaklorida
(awalan mono pada P tidak perlu di tulis )
NH3 = Amoniak ( tidak mengikuti aturan b dan c )
CO = Karbon monoksida
CO2 = Karbon dioksida
NO = Nitrogen monoksida
N2O3 = Dinitrogen trioksida
2. Senyawa Biner Unsur Logam - Non Logam
a. Unsur logam ditulis di depan dengan bahasa Indonesi, dan unsur non logam ditulis di belakang dengan akhiran -ida.
b. Jumlah muatan unsur logam menjadi indeks unsur non logam, demikian sebaliknya jumlah muatan unsur non logam menjadi indeks unsur logam.
c. Jika jumlah muatan unsur logam lebih dari satu maka untuk membedakan jumlahnya ditulis sebagai angka romawi di belakang unsur logam tersebut.
Perhatikan tabel berikut.
 |
| Kation ( atom bermuatan positif ) |
 |
| Anion ( atom bermuatan negatif ) |
Contoh :
NaCl = Natrium klorida
MgCl2 = Magnesium klorida
CU2O = Tembaga ( I ) oksida
CuO = Tembaga ( II ) oksida
NH4OH = Amonium hidroksida
D. MEMISAHKAN CAMPURAN MATERI
Untuk memisahkan campuran menjadi materi - materi dapat dilakukan dengan cara :
1. Distilasi
Proses pemisahan campuran yang penyusunnya berupa larutan. Contoh : proses pemisahana bensin dengan minyak tanah
2. Fitrasi
proses pemisahan campuran yang zat penyusunnya berupa cairan dan padatan dengan menggunakan saringan filter. Contoh : menyaring pasir dari air sungai yang mengandung pasir
3. Sentrifugasi
Proses pemisahan campuran yang zat penyusunnya berupa cairan dan padatan yang merupakan partikel yang sangat kecil dan tersebar merata dalam cairan. Contoh : pemisahan kapur dari cairan suspensi air kapur.
4. Kristalisasi
Proses untuk mendapatkan padatan dari suatu cairan larutan dengan pemanasan. Contoh : pada proses pembuatan garam dari air laut.
5. Kromatografi
Pemisahan campuran dengan memanfaatkan perbedaan sifat kepolaran zat. Contoh : pemisahan zat warna dalam tinta.
E. KADAR ZAT DALAM CAMPURAN
 |
| 1. Prosentase Massa |
 |
| 2. Prosentase Volume |
 |
| 3. Bagian Per Sejuta |
F. PERUBAHAN MATERI
1. Perubahan Fisika
Ciri-cirinya :
- yang berubah hanya sifat fisiknya saja
- susunan zat tidak mengalami perubahan tetap
- jenis zat tidak mengalami perubahan tetap
- pada umumnya dapat balik ke wujud semula
2. Perubahan Kimia
Ciri-cirinya :
- terjadi perubahan sifat : ada endapan, suhu berubah, ada gelembung gas, warna berubah
- terjadinya perubahan susunan zat
- terbentuknya zat baru dengan sifat yang sama sekali berbeda dengan asalnya ( permanen )
- tidak dapat di balik ke wujud semula
Langganan:
Komentar (Atom)