Dalam 1 mol zat terdapat 6,02 x 10 pangkat 23 partikel. Jumlah partikel zat di rumuskan dengan :
Keterangan :
n = mol
6,02 x 10 pangkat 23 = bilangan avogadro
Mr = Massa Molekul Relatif
Ar = Massa Atom Relatif
- Pada kondisi standar dimana suhu 0 derajat celcius dan tekanan 1 atm ( standard temperature and pressure = STP ) :
- Pada kondisi bukan standar maka kita gunakan rumus ideal :
Keterangan :
P = tekanan ( atm ) R = tetapan 0,08205 atm.L/mol.K'
V = volume ( liter) T = suhu ( kelvin )
N = mol
- Pada kondisi suhu dan tekanan sama ( P, T ) :
B. STOIKIOMETRI
Stoikiometri mempelajari semua perhitungan kimia secara kuantitatif, tidak terbatas pada unsur saja tetapi juga perhitungan senyawa maupun campuran.
1. Hukum - Hukum Dasar Kimia
Hukum Lavoisier ( Kekekalan Massa ) : Massa zat sebelum reaksi sama dengan massa zat setelah reaksi.
Hukum Proust ( Ketetapan Perbandingan ) : Suatu senyawa perbandingan massa unsur- unsur penyusunnya selalu tetap.
Hukum Dalton ( Perbandingan Berganda ) : Jika unsur A dan unsur B membentuk lebih dari satu macam senyawa, maka untuk massa unsur A yang tetap, massa unsur B dalam senyawanya berbanding sebagai bilangan bulat sederhana.
2. Hukum - Hukum Ilmu Kimia Untuk Gas
Hukum Gay Lussac ( Perbandingan Volume ) : volume gas - gas yang bereaksi dengan volume gas - gas hasil reaksi akan berbanding sebagai bilangan ( koefisien ) bulat sederhana juka unsur pada suhu dan tekanan yang sama.
Rumus :
Hukum Avogadro : Gas - gas dalam volume sama akan mempunyai jumlah molekul yang sama jika diukur pada suhu dan tekanan yang sama. Dalam 1 mol zat mengandung 6,02 x 10 pangkat 23 partikel, yang disebut dengan bilangan avogadro
Rumus :
Hukum Boyle ( Ketetapan Hasil Kali Tekanan dan Volume ) : Hasil kali tekanan gas dan volume gas akan selalu tetap jika diukur pada suhu dan tekanan yang sama.
Rumus :
Hukum Boyle-Gay Lussac : Hasil kali tekanan gas dan volume gas akan selalu tetap jika dibagi suhu mutlak.
Rumus :
C. RUMUS EMPERIS DAN RUMUS MOLEKUL
1. Rumus Emperis
Rumus emperis adalah rumus yang paling sederhana dalam kompilasi suatu senyawa
2. Rumus Molekul
Rumus molekul adalah kelipatan dari rumus emperis
D. MASSA ATOM RELATIF DAN MASSA MOLEKUL RELATIF
1. Massa Atom Relatif ( Ar )
Massa atom relatif ( Ar ) atau juga disebut bobot atom ( BA ) suatu unsur adalah massa satu atom unsur tersebut dibagi dengan 1/12 massa atom isotop karbon 12.
Menentukan Massa Atom Relatif Dari Isotop - Isotop di Alam
Di alam suatu unsur bisa didapatkan dalam 2 jenis atau bahkan lebih isotop, oleh karena itu kita dapat menentukan massa atom relatifnya dengan rumus berikut. Untuk n jenis isotop :
K = Kelimpahan
2. Massa Molekul Relatif ( Mr )
Massa molekul relatif ( Mr ) atau juga disebut bobot melekul ( BM ) suatu senyawa adalah massa satu molekul senyawa tersebut dibagi dengan 1/12 massa satu atom isotop karbon 12.
E. AIR KRISTAL
Air kristal ( hidrat ) adalah air yang terikat pada suatu kristal senyawa tertentu dengan perbandingan molekul yang tertentu pula. Air ini dapat dibebaskan melalui pemanasan. Contoh air kristal : CuSO4.5H2O, FeSO4.7H2O, 2H2O dsb.


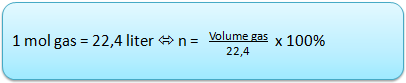









Tidak ada komentar:
Posting Komentar