A. STRUKTUR ATOM
1. Perkembangan Model Atom
- Model Atom Dalton
- Atom mempunyai sifat yang sama atau identik untuk unsur tertentu
- Atom akan berikatan untuk membentuk suatu molekul
- Model Atom Thomson
- Terkenal dengan model atom roti kismis, terkena bagian pejal bermuatan positif dan elektron ( bermuatan negatif ) mengelilingi seperti kismis dalam roti.
- Model Atom Rutherford
- Atom bersifat netral karena jumlah muatan positif sama dengan jumlah muatan negatif.
- Model Atom Niels Bohr
- Elektron beredar pada lintasan dengan tingkat energi tertentu.
-Perpindahan elektron disertai penyerapan atau pelepasan energi
- Atom seperti sistem tata surya yaitu inti atom sebagai matahari dan elektron sebagai planet-planet di sekitarnya dalam orbit tertentu.
- Model Atom Broglie ( Mekanika Gelombang )
- Elektron tidak mempunyai lintasan tertentu. Elektron menempati jarak-jarak tertentu dari inti atom.
-Kedudukan elektron tidak dapat dipastikan, hanya merupakan kebolehjadian.
2. Partikel Dasar Penyusun Atom
3. Lambang Atom
Atom Netral = Atom yang tidak bermuatan listrik
- Proton = Elektron = Nomor Atom
- Netron = Massa Atom - Nomor Atom
Atom yang kelebihan elektron karena masuknya elektron unsur lain kedalam atom tersebut.
- Proton = Nomor Atom
- Elektron = Nomor Atom + Muatan
- Netron = Massa Atom - Nomor Atom
4. Nuklida
adalah inti atom suatu unsur yang mengandung proton dan netron
- Isotop adalah nuklida yang mempunyai nomor atom sama tetapi massa atomnya berbeda atau jumlah proton sama tetapi jumlah netron berbeda.
- Isobar adalah nuklida yang mempunyai nomor atom berbeda tetapi massa atomnya sama
- Isoton adalah nuklida yang mempunyai jumlah netron yang sama tetapi nomor atom dan massa atomnya berbeda.
B. KONFIGURASI ELEKTRON
adalah suatu susunan mengenai penyebaran elektron pada kulit suatu atom.
1. Bilangan Kuantum
Bilangan yang menentukan letak keberadaan elektron pada kulit suatu atom
a. Bilangan Kuantum Utama ( n )
Menyatakan nomor kulit tempat elektron berada, jenisnya : K ( n = 1 ), L ( n = 2 ), M ( n = 3 ).
b. Bilangan Kuantum Azimuth (e)
Menyatakan subkulit tempat elektron berada, jenisnya :
c. Bilangan Kuantum Magnetik ( m )
Menyatakan orbital tempat elektron berada, jenisnya :
d. Bilangan Kuantum Spin ( s )
Menyatakan arah elektron dalam orbital.
+1/2 dan -1/2 untuk orbital dalam harag m, untuk menentukan letak elektron maka perlu mengikuti aturan-aturan tertentu yang sudah ditetapkan.
Aturan Aufbau
Elektron - elektron yang megisi orbital dari tingkat energi terendah kemudian tingkat energi yang lebih tinggi
Diagram dibawah ini adalah cara untuk mempermudah menentukan tingkat energi orbital dari yang terendah ke yang lebih tinggi, berikut diagramnya
Contoh :
Atom Li mempunyai 3 elektron maka konfigurasinya adalah : 1s2, 2s1
Atom Fe mempunyai 26 elektron maka konfigurasinya adalah : 1s2, 2s2, 2p6, 3p6, 4s2, 3d6
Autarn Hund :
Elektron- elektron tidak membentuk pasangan elektron sebelum masing-masing orbital terisi sebuah elektron
Larangan Pauli :
Tidak diperbolehkan di dalam atom terdapat elektron yang mempunyai keempat bilangan kuantum yang sama
2. Beberapa Hal Penting Yang Perlu Diperhatikan Dalam Konfigurasi Elektron
a. Cara Menuliskan Urutan Subkulit
- Subkulit dituliskan berdasarkan tingkat energinya
(Ga) = 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p1
Tingkat energi subkulit 4s lebih rendah dari subkulit 3d, maka akan terisi elektron terlebih dahulu dan di tulis lebih dahulu.
- Subkulit ditulis berdasarkanurutan kulit utamanya
(Ga) : 1s2, 2s2, 2p6, 3s2, 3p6, 3d10, 4s2, 4p1
Walaupun tingkat energi subkulit 4s lebh rendah dari subkulit 3d, tetapi penulisannya berdasarkan urutan kulit utamanya adalah seperti di atas, jadi 3d di tulis lebih dulu
- Subkulit di tulis dengan menggunakan konfigurasi gas mulia
( Ga ) : [Ar] 4s2, 3d10, 4p1 atau [Ar] 3d10, 4s2, 4p1
Gas mulia disini yang dipakai adalah Argon (Ar) yang mempunyai nomor atom =18
b. Aturan Penuh-Setengah Hund
Dalam percobaan ternyta di temukan beberapa penyimpangan aturan Aufbau, sebagai contoh adalah untuk konfigurasi elektron kromium ( Cr ) dan tembaga ( Cu ) :
- Berdasarkan aturan Aufbau
- Berdasarkan percobaan menjadi :
- Cu : 1s2, 2s2, 2p6, 3s2, 3p6, 4s1, 3d10 atau [Ar] 4s1, 3d10 ( penuh untuk sub kulit d )
untuk subkulit d, terisi elektron setengah penuh atau penuh ternyata lebih stabil dibandingkan jika menggunakan aturan Aufbau.
C. SISTEM PERIODIK UNSUR
Adalah susunan unsur-unsur berdasarkan kenaikan nomor atom dan kemiripan sifat-sifat yang dimiliki oleh masing-masing unsur
Henry G. Moseley
Menemukan sistem periodik unsur modern dan menyatakan sifat unsur merupakan sifat periodik dari nomor atomnya dimana nomor atom merupakan jumlah proton dan eletron sebuah unsur netral. SPU Modern tersusun atas :
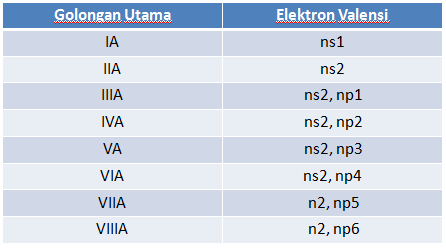
1. Golongan
Baris vertikal menyatakan unsur-unsur yang segolongan. Segolongan berarti mempunyai elektron valensi ( elektron pada kulit terluar ) sama.
Golongan = Elektron Valensi
ada dua golongan unsur-unsur dalam SPU : Golongan Utama adalah Golongan A dan Golongan Transisi adalah Golongan B
Nama Golongan Pada Golongan Utama :
2. Periode
Baris horizontal menyatakan unsur-unsur yang dilaluinya sebagai unsur-unsur yang seperiode, seperiode berarti mempunyai jumlah kulit atom sama. Periode = Jumlah Kulit
D. SIFAT PERIODIK UNSUR
1. Jari-jari atom adalah jarak antara inti atom dengan kulit atom paling luar yang ditempati elektron dan diukur ketika atom tersebut baerikatan.
2. Potensial ionisasi ( energi ionisasi ) adalah energi yang di butuhkan untuk membebaskan satu elektron suatu atom pada keadaan gas.
3. Afinitas elektron adalah energi yang dibebaskan atom netral dalam pengikatan elektron untuk membentuk ion negatif
4. Kelogaman dan keasaman
5. Elektonegatifitas adalah kedendrungan suatu atom menarik pasangan elektronnya dalam molekul. Maksimum di golongan halogen, gas mulia lebih kecil keelektronegatifannya di banding Halogen.
6. Kereaktifannya, yaitu kemudahan melakukan reaksi denga unsur lain.










Tidak ada komentar:
Posting Komentar